第3章―3 鰭と四肢
鰭から四肢への変遷概要
現生魚類の鰭骨格と四肢類の肢骨格の対応を明らかにするのは困難であるが、魚類の対鰭が陸棲脊椎動物の前肢と後肢へと進化したことは既にダーウィンが指摘している。脊椎動物の陸棲化に際して、胸鰭や腹鰭といった対鰭の四肢への変遷は顕著であり、また発生に際して他の器官とは比較的独立して扱えるので、四肢への進化の過程に関する研究は非常に多く、解明も進んでいる。
対鰭は冠顎口類の基本的な特徴とされるが、胸鰭は既に無顎類の時代に獲得していた(Coates 2003)。その後顎口類の板皮類が出現した頃にもう一方の対鰭である腹鰭を獲得した。二つの対鰭、胸鰭と腹鰭を獲得した棘魚類や初期硬骨魚類も相次いで出現した。そして初期硬骨魚類からシルル紀後半には条鰭類と肉鰭類が分岐し、各々の系統で独立に鰭が進化した。肉鰭類の中から肉鰭を四肢に進化させた四肢類がデボン紀末に出現した(Shubin 1995)。
何故四肢が獲得されたのかに関してはいくつかの仮説が提案されている。長い間信じられてきたのが、ローマーによる「涸れ池」から水を求めて移動するために鰭が四肢化したという仮説である。この仮説は「涸れ池」ばかりでなく、「酸素欠乏」や「過剰個体数」などの悪化した棲息環境か逃れるために四肢が形成されたと解釈することも可能である。 385Mya頃淡水に棲息していた四肢様魚類のユーステノプテロンの対鰭は四肢と似た骨格構造を持っている。ローマーの仮説に基づくと、この鰭は旱魃時には水を求めて陸上を移動するために、そして普段は水底を移動するのに四肢と同じように使われたと考えられた。しかし、現生シーラカンスは鰭を水底移動に使っていないことが明らかになった。また、条鰭類においては鰭条を曲げられる構造にし、これを使って水底を移動するものも多い。従って、肉鰭から四肢へと進化する必然性は必ずしも無いと云える。最近では、鰭から四肢へと進化したのは、歩くためではなく草木類が繁茂した浅瀬をかきわけて移動するためである、とする説が有力になっている。
対鰭の起源
対鰭の起源に関しては19世紀末にBalfourが鰭ひだ仮説を出している(Janvier 1996)(Coates 2003)。この仮説によると対鰭は最初に体側面に一続きの鰭ひだとして出現したと考えられている。この一続きの鰭ひだが、顎口類に進化したときに中央部が消失し、胸鰭と腹鰭になったとされる。実際ヤツメウナギ目のヤモイティウス:Jamoytiusは鰭ひだを持っていたようである。また、棘魚類のクリマティウス:Climatiusは頭部から尾部にかけて7対の鰭を持っている。こういったことは鰭ひだ仮説を支持すると考えられた。
対鰭形成に関与する遺伝子の種類は後述するように多いが、中胚葉誘導により側板中胚葉から発生する現生ヤツメウナギの鰭ひだから有羊膜類の肢まで鰭形成プログラムは保存されている(Freitas et al. 2006)。従って、鰭ひだ仮説はエヴォ・デヴォの方からも支持されていると考えられた(Cohn et al. 1995)。
ところで化石記録からは、対鰭に先立って正中線上に背鰭や尾鰭といった非対鰭が出現していることが明らかになっている(Zhang & Hou 2004)。中国のYunnan地方のカンブリア紀初期、520Mya頃の地層から出土した無顎類のMylokunmingiaに既に正中線に沿って背側と腹側に鰭の原型が見られる。また、Haikouichthysの背鰭には第2章の図1で見たように鰭条様の構造も見られる(Shu et al. 1999)。しかし、この鰭様の器官には内骨格や筋肉は無かったとされる(Coates 2003)。
遺伝子解析により、硬骨魚類や軟骨魚類の発生段階において、正中線上の鰭でも胸鰭や腹鰭と同様Hox9-13の発現が確認された(Cole 2007)(Freitas et al. 2006)(Long et al. 2006)(Caotes 1994)(Yonei-Tamara et al. 2008)(Akimenko et al. 1995)。
即ち、正中線上の鰭ひだ形成のために生じた遺伝子プロセスが、胸鰭や腹鰭といった対鰭形成にもリクルートされたと考えられた。対鰭ばかりでなく尾鰭も含めた正中線上の鰭類も鰭ひだ仮説で説明できるとされた(Cole 2007)(Neyt et al. 2000)。
顎口類では背中の正中線鰭形成と左右腹部側の付属肢形成の際に肢芽先端部上皮と間充織でmox1が発現しており、軟骨魚類でも同様な発現が見られる(Akimenko et al. 1995)。また、鰭原基の前後軸を決めているShhの発現が軟骨魚類でも鰭原基後端に見られ、Shhシグナルも顎口類出現の初期から鰭形成に関与していることが明らかにされた(Yonei-Tamara et al. 2008)(Dahn et al. 2007)。こういったことから、鰭は最初正中線に沿った鰭ひだと体側部に沿った鰭ひだとして出現し、これら鰭ひだを制御する遺伝子の発現パターンを少し変えることで、正中線に沿った鰭ひだから尾鰭や背鰭が、体側部に沿った鰭ひだから対鰭である胸鰭や腹鰭が形成されたとするモデルが妥当であると考えられた(Long et al. 2006)(Gillis et al. 2009)。
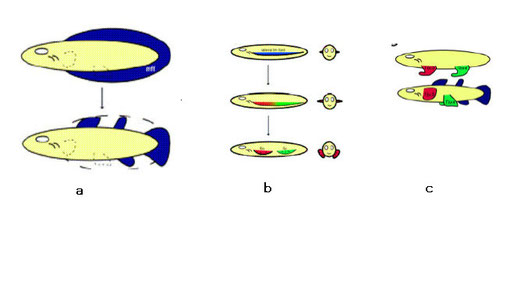
From Cole 2007
しかし、鰭ひだ仮説に基づくと胸鰭と腹鰭は同時に出現することを予想させるが、先述のように、化石記録からは胸鰭を持ったのは無顎類のAnaspidaが最初であり(Long 2011)、その後に現れたThelodontiの胸鰭が四肢類の前肢につながり、腹鰭は後に現れた顎口類の段階で獲得されたとされる(Marss & Ritchie 1998)。また、鰭ひだ仮説に基づくと鰭形成を主に支配しているHox遺伝子は胸鰭ではHox1,2といった若い番号の遺伝子、腹鰭ではHox番号の大きい遺伝子になっていることが予想されるが、実際には胸鰭も腹鰭もHox9~13遺伝子が関与している(Coates & Cohn 1999)。これに対してTabin & Laufer 1993は前鰭は後鰭のHox9~Hox13を転用したとするモデルを提案して鰭ひだ仮説を擁護している。
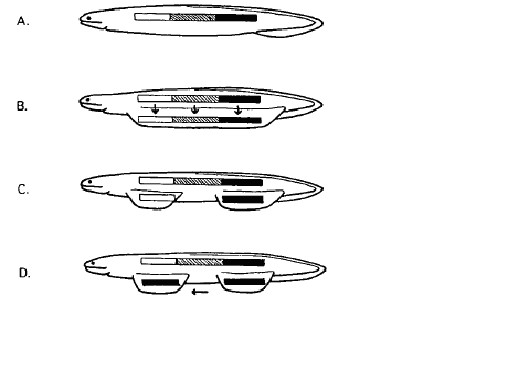
A. B. 体部と同じHox遺伝子により鰭ひだが形成。C. 鰭ひだの中央部が消失。D. 胸鰭
Hox遺伝子が腹鰭から転用(recurite)される。 From Coates & Cohn 1999
しかし、軟骨魚類の発生期における鰭の形成過程を詳細に追った結果、鰭ひだ仮説を支持するような現象は観察されなかった(Tanaka et al. 2002)。また、正中線上の鰭と対鰭は、共にHoxd、Tbx18遺伝子など共通の遺伝子を使用しているが、非対鰭は体節中胚葉(somatic mesoderm)由来であり、一方、対鰭は側板中胚葉(lateral plate mesoderm)由来であることが明らかになった(Freitas et al. 2006)(Akimenko et al. 1995)。さらに化石記録から正中線鰭が対鰭より先に出現している(Zhang & Hou 2004)。また、胸鰭と腹鰭が似てくるのは肉鰭類になってからであり、それ以前には胸鰭と腹鰭では構成骨の複雑さが違うので別個に進化したことが予想される(Coates & Cohn 1999)(Coates 2003)。
現時点では完全に否定されたわけではないが、鰭ひだ仮説は否定的に捉えられているようである。いずれにせよ、鰭形成の、そして四肢形成の遺伝子はカンブリア紀初期の無顎類にまで遡ることになるし、四肢の起源となる対鰭の獲得もオルドビス紀末からシルル紀初期にかけて出現した無顎類の欠甲目までたどることになる。また、腹鰭の獲得は顎口類になってからであり、胸鰭の獲得よりやや遅れている。
鰭ひだ仮説に基づくと前肢と後肢は相同器官とみなせるが、胸鰭と腹鰭は別個に進化したとすると前肢と後肢は相同器官でなくなる。後者が正しいとすると、発生時に発現する遺伝子系がたとえ同じであってもそれだけで相同器官と結論することは出来ないことを示唆している。
対鰭の進化
化石記録から、最初に対胸鰭を獲得したのは欠甲目とされる。欠甲目グループのThelodonti 、Galeaspids 、Osteostraci、Pituraspidaは頭部を外骨格の甲皮で覆われており、背鰭、尾鰭、あるいはその両方を持つものが多い。一方Anaspidaの頭部に甲皮は無く、小さな鱗で覆われ対鰭を持っており、他の欠甲目に比べて遊泳性に優れていたと考えられる。しかし、最初に対鰭を持ったとされるAnaspidaの対鰭は筋肉や内骨格を持たず(Sansom et al. 2000)、後に四肢へ展開する対鰭とは無関係とされる(Coates 2003) (Coates & Cohn 1999)。恐らくこの対鰭は運動器官というよりは平衡器官として機能していたのであろう(ブライアン・ホール)。Anaspidaに続いて出現した底生だが遊泳能力が高いと予想されるThelodontiの胸鰭は鰭条が無くフラップ状であり、軟骨魚類の鰭に似ている。従ってその後の条鰭類や四肢類の対胸鰭とは相同ではないとされる。相前後して出現したGaleaspidsは対胸鰭を持っていない。
顎口類の胸鰭につながる内骨格を持った対鰭は骨甲類(Osteostraci)が最初とされる(Janvier 2004)( Sansom et al. 2000)。骨甲類の系統のAteleaspisあたりで獲得した胸鰭がその後の魚類や四肢類の胸鰭、前肢へとつながる最初のものと考えられている。
カナダのデボン紀後期の地層から出土したOsteostraciの1種であるEscuminaspis の胸鰭の近位部は単一の軟骨の板状内骨格を備えている(Janvier 2004)。これは、胸鰭の進化において最初に形成された内骨格の肩帯が単一の骨格であったことを示唆していると考えられる。無顎類の段階で形成された柱脚骨が、顎口類に移行する段階で肩帯に関節した。即ち胸鰭の場合、最初に肩甲骨に相当する肩帯と呼ばれる骨が形成され、この骨に柱脚骨が関節されて胸鰭が出来たと考えられる。
Thelodontiの腹部に弱い突起状の膨らみは腹鰭の前駆とはみなされず、腹鰭は顎口類になってから獲得した器官である。
現生硬骨魚類の腰帯は内骨格のみで形成され、板皮類や棘魚類では皮骨で形成されている。しかし、腹鰭と胸鰭の発生に関与する遺伝子の間には類似性が見られる。一方、硬骨魚類の腹鰭の進化の過程を追える化石記録は少ない。こういったことのために腹鰭の起源ははっきりしていなかった。最近GuiyuやPsarolepisの腹鰭が皮骨で構成されていることが示され、腹鰭の初期の進化の様相が明らかにされた(Zhu et al. 2012)。即ち、腹鰭の場合も最初に骨盤へと進化する腰帯が形成され、これに皮骨から形成された柱脚骨が関節したと考えられる。
板皮類は胸鰭を持つが、6グループのうち2乃至3グループ(Petalichthyida, Antiarcha, Acanthothoraci)は腹鰭を持たず、2グループのみが腹鰭を持っている。また、棘魚類ではほとんどの種が胸鰭と腹鰭を持つが、腰帯の発達が悪い種もある(Coates 2003)。腹鰭は獲得当初には安定した存在ではなかったようである。同時代に棲息していた板皮類は底生性であり、棘魚類は遊泳性であり(Smith et al. 2002)、各々生態系を棲み分けていたと思われる。従って、腹鰭は遊泳機能とより直接的な関係があったと考えられる。
板皮類とほぼ同時代に既に軟骨魚類は出現していたが、鰭に関する情報が残っている化石は409MyaのDoliodusが最古のものである。棘魚類に似た棘のある胸鰭を持っているが、上半身しか残っていないため腹鰭の形態は不明である(Miller et al. 2003)。しかし、軟骨魚類は遊泳性であり、その初期から胸鰭と腹鰭を持っていたであろうと予想される。
魚類の胸鰭と腹鰭の違いは一般的には大きい。条鰭類の対鰭は遊泳時の推進以外にも3次元的な空間を遊泳するための微妙な調整を行う機能を持つため胸鰭と腹鰭で役割が異なることが多く、そのために一般的には形状や位置の違いが大きい。一方、Eusthenopteron以降の肉鰭類の対鰭は遊泳よりも水底を移動するための機能を持つと考えられ、胸鰭と腹鰭の形状の違いは一般的には小さいようである。
初期硬骨魚類の鰭から四肢へ
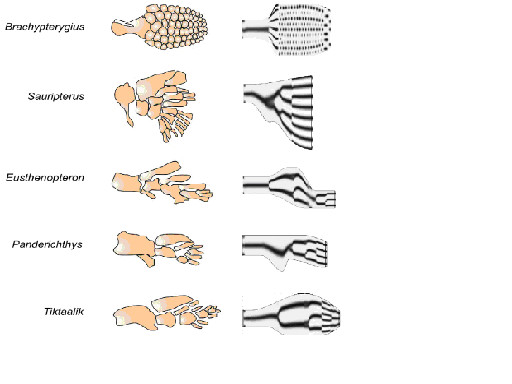
化石記録の蓄積の結果、肉鰭から四肢への変遷の過程が、機能面の理解を含め、明らかになってきた。しかし、化石で得られた鰭や初期四肢の形態は多様であり、構成する骨の相同性を明らかにすることは困難が伴う(Coates 2002)(Johanson 2010)。また、肉鰭類に先行する初期硬骨魚類の鰭に関しては化石情報が少ない。
軟骨魚類は455Myaには出現していたと考えられ(Janvier1996)、一方初期硬骨魚類から条鰭類と肉鰭類は420Myaには分岐していたとされる(Zhu et al. 2009)。従って、初期硬骨魚は430Mya頃に棲息していたと予想されるが、この時期の初期硬骨魚の化石記録は断片的なもの以外はほとんど無い。従来は魚類から両生類への進化の過程で肉鰭類が現れたと考えられ、条鰭類から肉鰭類が進化したとされてきた。従って初期硬骨魚は条鰭類に近い形をしていたと予想され、鰭も条鰭類のそれに近いと考えられた。しかし、最近の鰭化石の詳細観察やエヴォ・デヴォの研究では、初期硬骨魚類の鰭形状は条鰭ではなく軟骨魚類の鰭形状に近いとする説が有力になってきている。
この説に基づくと、軟骨魚類の鰭に似た初期硬骨魚類の鰭から肉鰭類の鰭、さらに肢へと進化したことになるが、しかし、現生の軟骨魚類と四肢類では鰭・肢の近位の骨に大きな違いが見られる。軟骨魚類は肩帯の近位から遠位方向に3本の柱脚骨:propterygium, mesopterygium, metapterygiumを持っている。一方、現生の多くの条鰭類は前柱脚:propterygiumと 中柱脚:mesopterygiumを持ち、四肢類では後柱脚:metapterygiumのみからなっている (Ahn & Ho 2008)。即ち、3本の柱脚骨は初期の顎口類に共通した特徴と考えられた(Coates 2003)。肉鰭類は進化の過程で3本の柱脚骨の内2本を失ったことになる。図3に従来考えられてきた軟骨魚類と条鰭類の胸鰭、及び四肢類の前肢における骨格の対応関係を示す。
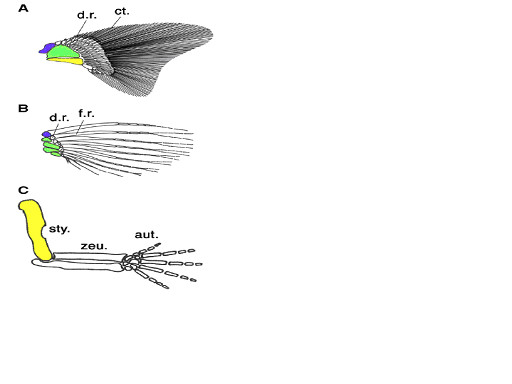
(A)軟骨魚類の胸鰭:多くの軟骨魚類の鰭は3本の柱脚骨:pterygiumを持つ (B) 条鰭類ゼブラフィシュの胸鰭 (C) 哺乳類マウスの前肢 青:前柱脚、緑:中柱脚、黄:後柱脚。
d.r.:遠位放射骨:distal radius:柱脚骨に隣接して並んでいる豆粒状の骨、f.r.:鰭条、sty:柱脚:stylopod、zeu:軛脚(やっきゃく):zeugopod、aut:自脚:autopod
From Ahn & Ho 2008
2章の図6に基づくと、現生のヘラチョウザメは初期硬骨魚の形態を残していることが予想される。ヘラチョウザメとゼブラフィシュの鰭、およびマウスの肢の内骨格原基となる細胞の増殖を決めるHoxd13遺伝子の発現を比較した結果、鰭形成後期に肢芽の外胚葉性頂堤AER:apical ectodermal ridgeでHoxd13が機能しないと条鰭になり、Hoxd13が活性化するとヘラチョウザメの鰭になり、Hoxd13が強化されると肢が形成されることが示された(Davis et al. 2007) (Freitas et al. 2007)。この実験結果は、ヘラチョウザメと初期硬骨魚類の鰭が軟骨魚類の鰭に似ていることを示している。また、Tiktaalik以前の初期肉鰭類の鰭がヘラチョウザメの、従って軟骨魚類の鰭に似ていることを示唆している。

a : 後期段階におけるHoxD発現の獲得 b:前柱脚(propterygium)と中柱脚 (mesopterygium)の消失 c:皮骨性鰭条の消失 d:後柱脚(metapterygium)の消失 e:発生後期段階におけるHoxD発現の消失。青色の模式図:後期段階におけるHoxDの発現形態 From Davis et al. 2007
初期硬骨魚類から420Myaまでには肉鰭類が分岐し、420~410Myaにかけて肉鰭類からシーラカンス類、ハイギョ類、そして後の四肢類へとつながる系統が相次いで分岐し、各々の棲息環境で独立に鰭を進化させた。シーラカンス系と四肢類系の胸鰭は広くて扇型をしており、顕著な非対称性を示している。この胸鰭の形態はハイギョの系統以外の初期肉鰭類で共通しており、遊泳性に関係する特徴と考えられる(Friedman et al. 2007)。
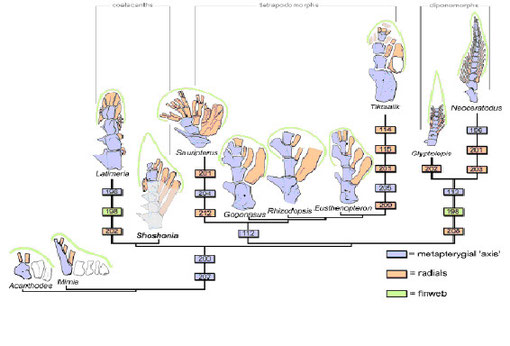
色は部位を、数字は部位における特徴の違いを、そして線の長さは各系統に到る特徴の違いを表す。 From Friedman et al. 2007
一方、初期肉鰭類のPsarolepisやAchoaniaの胸鰭を3次元x線解析により詳細に調べた結果、軟骨魚類と同様3本の柱脚骨を持つことが、また、シーラカンスやハイギョでは後柱脚:metapterygiumを持つことが、条鰭類の多くは前柱脚:propterygiumと 中柱脚:mesopterygiumを持つが、所謂現生の古代魚では3本の柱脚を持つ種類もいることが明らかになった(Zhu & Yu 2009)。さらに棘魚類や初期条鰭類とされるMimiaでは3本の柱脚骨を持っていたが、板皮類の柱脚骨は1本であることも明らかにされた。これらを説明できる系統樹として図6が提案されている。
初期硬骨魚類の鰭は肩帯に3本の柱脚骨でつながっていたと考えられる。従って、柱脚骨を含め、初期硬骨魚類や軟骨魚類、棘魚類といった初期魚類の鰭は、扇型であり、鰭条もあまり発達していなかったであろう。
初期硬骨魚類から分岐した後、肉鰭類の鰭は最初初期硬骨魚類と同様3本の柱脚骨で肩帯に関節していたが、デボン紀初期、シーラカンスやハイギョの系統が分岐するまでには2本の柱脚:propterygium, mesopterygiumだけになっていた。

単系統の肉鰭鰭は、遅くても416Myaまでには幹肉鰭類:Psarolepis & Achoaniaと冠肉鰭類に分岐している。紫(冠肉鰭類):前柱脚と中柱脚を持たない。青:前柱脚と中柱脚を持つ。赤:後柱脚軸、緑色部:後柱脚、灰色部:肩甲骨の烏啄骨部。負号は欠失した柱脚部を意味する。挿入図:Mimiaの肩帯部であり、3の柱脚を持つ。内骨格板:endoskeletal discとfgf24遺伝子の発現の有無を上欄に示す。fgf24*:fgf24 と相同と思われ、軟骨魚類に見られる(Draper et al. 2003) From Zhu & Yu 2009
こういったことから、初期硬骨魚類の鰭の形態は、古生代の軟骨魚類に近い骨格を持ち、鰭条はあったにしても発達したものではなく先端部に持っていた程度とする説がもっともらしいと考えられる。このような鰭から 条鰭と肉鰭が分岐し、各々独立に進化したことになる。
なお、最近になって初期硬骨魚類の鰭形状が条鰭類の鰭形状に近いとする説が再び出てきている。ゼブラフィシュにおいてサメの鰭に見られる繊維状コラーゲンであるエラストディンの主要成分蛋白質And1 :actinodin1とAnd2 :actinodin2を産生する遺伝子and1とand2のノックアウト種による鰭形成を調べた。その結果and1とand2が無いと初期四肢類の鰭に似てくることが明らかになった。従って、初期硬骨魚類の鰭が条鰭魚類の鰭に近い形をしており、この初期硬骨魚類の中からand1, and2を失って肉鰭類が生まれたとしている。特に鰭形成の後期段階でHoxD遺伝子が不活性化すると鰭条形成に関与する2種のコラーゲン、actinodin 1 とactinodin 2を産出出来なくなるため肉鰭が生じるとされる(Zhang et al. 2010)
しかし、逆に肉鰭類の鰭形状を持った祖先がand1、and2を活性化して条鰭類の鰭を得たとも解釈出来ると思われる。また、鰭条を持つ鰭が条鰭類という定義であれば、先端に鰭条を持つTiktaalikも条鰭類として分類されてしまうことになる(Ahn & Ho 2008)。条鰭の有無だけで条鰭か、肉鰭かを区別することは出来ない。
軟骨魚類から四肢類に到る前部付属肢構成骨の対応関係と進化の過程を図7にまとめる(Abbasi 2011)。

四肢様魚類において後柱脚metapterygium (black) が遠近軸の前方に向かって曲がり指弓(digital arch:Da)を形成したことが指形成に結びついた。従って、前方指d1が最遠位になる。指形成は軟骨魚と硬骨魚の共通祖先で見られる発生後期におけるHoxd発現が関与している。後放射骨:mtr: metapterygial radials:赤、中放射骨:mer: mesopterygial radialsと遠位放射骨:dr: distal redials:白抜き、指:D1-5: digit1 to digit5、橈骨:Ra: radius、尺骨:Ul: ulna、上腕骨:Hu: humerus From Abbasi 2011
四肢類の系統において胸鰭から前肢への変遷が起こったが、肉鰭と肢の区別も必ずしも明確でない。先端部(遠位部)に鰭条を持っていれば肉鰭であり、指であれば肢であるとする簡単な定義はおおむね認められている。従って、図8に示すように、鰭から肢への遷移はTiktaalik の出現後であり、Acnathostega の出現前の時期となり、370Mya頃となる(Long et al. 2006)(Shubin et al. 2006) (Yano & Tamura 2012)。しかし、四肢の特徴である柱脚の1本化はTiktaalik の出現前、Eusthenopteronの頃である。

TiktaalikとAcanthostegaでは、発生の初期においてHoxA遺伝子が付属肢先端部(赤で示す)で発現したであろう。EusthenopteronやTiktaalikの鰭では、先端部にある遠位細胞は鰭の外側へと拡散し、鰭条を形成したであろう。一方AcanthostegaやOphiacodonでは、先端部にある遠位細胞は拡散せずに留まり、肢の遠位部の指形成に関与したであろう。
From Ahn & Ho 2008
自脚形成と指の数
ユーステノプテロン:Eusthenopteronでは四肢類の上腕骨、尺骨、橈骨に相同な骨の形成が見られるが、先端部の骨については四肢類の骨との相同性は明確では無い。即ち、自脚(手根骨、中手骨、指骨)を除いては、四肢の基本的な骨格はユーステノプテロンの段階、即ち385Myaには既に獲得されていたことになる。鰭から肢への陸棲化の過程において末端部の追加、または消失は、従来考えられていた以上に重要であることが明らかになった(Coates et al. 2007)。
指は四肢類が始めて獲得した新奇な形態とする説が90年代に提案され(Coates et al. 2007) (Sordino et al. 1995)、有力視されてきた。しかし、最近のパンデリクティスの胸鰭のCT解析やサメとハイギョの鰭形成過程の詳細観察から、肉鰭類が共通に持っている遠位放射骨:distal radialsが四肢類の指と相同であり、指は四肢類における新奇形態ではないと結論された(Boisvert et al. 2008)(Hinchliffe 2002)。さらに従来指は中胚葉から、鰭は外胚葉神経堤から形成されるとされていた (Ahn & Ho 2008)。しかし、指と鰭条とは同じ骨芽間充織細胞から形成されることが明らかにされた(Mabee 2000)(Metscher et al. 2005)(Davis et al. 2007)。
即ち、初期四肢類において指を持っていたのはアカントステガ、イクチオステガ、チュレルペトンの3種だけであったが、新奇に獲得されたものではなかった。しかし、アカントステガの前肢とイクチオステガの後肢の指の数はそれぞれ8本、7本である。こういった5本以上の指の存在も含めて指の形成を説明出来るモデルが、発生学の観点から提案されている(Shubin & Alberch 1986)。
最初に上腕骨が生じ、この先端が外へ向かって成長し、分岐過程を経て新たに二個の要素が生み出される。分岐して生じた二個のうち主軸となる一個は尺骨になると共にもう一度分岐する。二度目の分岐をした二個のうち主軸要素は湾曲して指弓を形成し、そこから指の骨が生じる。もう一方の分岐要素から複数の小さな要素が生じる。一方、最初の分岐で生じたもう一つの要素はその後分岐を起こさず橈骨と複数の小さな要素となる。二回の分岐で生じた複数の小さな要素は指以外の自脚構成骨となる。
このモデルでは、鰭主軸軟骨の後方放射骨:metapterygial radialsが湾曲して指弓を形成し、そこから指の骨が分岐している。即ち、自脚や橈骨は軸前放射骨と相同であり、指骨は軸後放射骨と相同になる。この発生学に基づく解析だと、指が5本以上生じることも説明できる。
体軸方向を決めるHox遺伝子は、付属肢の軸決定にも使われており、HoxA遺伝子は付属肢の遠近軸に、HoxD遺伝子は付属肢の前後軸に沿って発現することが明らかにされた(Yokouchi et al. 1991)。その後マウス、チキン、ゼブラフィシュの付属支におけるHoxd-11遺伝子の発現を比較する実験が行われ、主軸が湾曲し指弓を形成するというモデルが支持された(Nelson et al. 1996)。
また、四肢類の自脚形成においては間充織細胞の増殖が必要であり、外胚葉上皮がこの増殖を助長している(Villavicencio-Lorini et al. 2010)。条鰭類では間充織細胞の増殖が見られない。実際四肢類の肢芽において、発生の初期段階のPhase1では先端部でHoxa-11の発現が見られるが、Phase2になるとHoxa-11は先端部では発現しなくなり、肢芽の軛脚部に対応した領域で発現している(Nelson et al. 1996)。Hoxa-11の発現が見られない先端部では間充織が形成され、これが指形成を可能にしていると考えられた。こういったHoxAやHoxD遺伝子等の発現パターンの変更により鰭条を持った鰭から指や掌を持った肢へと進化したことになる。
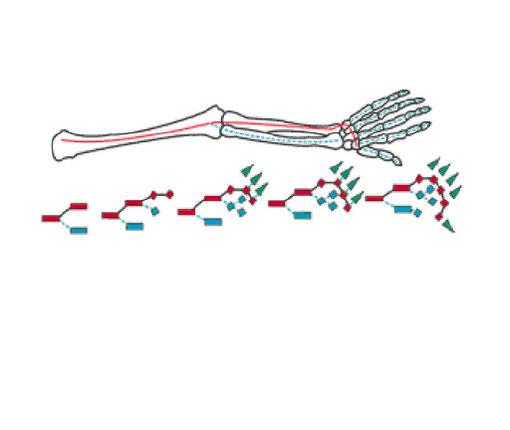
鰭から四肢への進化・発生学
陸棲化に伴う鰭から四肢への形状変化は大きく、現生種の鰭骨格と四肢骨格の相同性を見ることは困難である。また、鰭骨格の大きな部分を占める鰭条は外骨格性であるが、肢の骨格は内骨格性である(Tamura 2008)。しかし、90年代には鰭と肢の形状の大きな違いにもかかわらず発生段階において関与する調節遺伝子やその機能の違いは小さいことが明らかになった(Grandel & Schulte-Merker 1998)(Ruvinsky 2000)。一方、自脚、とりわけ指の起源に関しては長いこと議論されてきた(Laurin et al. 2000)。当初指の起源は鰭における鰭条とされたが、90年代に指は四肢類が始めて獲得した新奇な形態とする説が提案され(Coates et al 2007) (Sordino et al. 1995)、決着したと思われた。しかし、最近になって肉鰭類の遠位放射骨:distal radialsが四肢類の指と相同であり、指は四肢類における新奇形態ではないと考えられている(Boisvert et al. 2008)(Hinchliffe 2002)。
鰭と四肢の大きな違いや指の起源を明らかにするために2000年代以降になると、鰭や四肢に関しても軸性の器官構造形成において転写制御因子として機能するHox遺伝子を中心に多くのエヴォ・デヴォの研究が行われている(Zhang et al. 2010) (Ahn & Ho 2008) (Freitas et al. 2007)(Davis et al. 2007)(Freitas et al. 2006)(Haines & Currie 2001)(Neyt et al. 2000) (Friedman et al. 2007)(Coates & Cohn 1999)(Dahn et al. 2007)(Akimenko et al. 1995)(Wagner & Chiu 2001)(Metscher et al. 2005)(Caotes 1994)(Tarchini & Doboule 2006) (Hinchliffe 2002) (Sordino 1995)(Yano & Tamura 2012)(Mabee & Noordsy 2004)等。
鰭と四肢ではその機能も形状も大きく異なっているが、さらに鰭においても棲息環境などによってその形状・機能は多様であり、四肢においても同様多様化している。一方、胸鰭や肩帯は鰓弓起源であるが、胸鰭より後に出現した腹鰭や腰帯は鰓弓起源ではない(Coates 2003)。また、脊椎動物の付属肢形成には、鰭芽や肢芽の段階でTbx5が発現すると胸鰭や前肢に、Tbx4が発現すると腹鰭や後肢になる(Rodoriguez-Esteba et al. 1999)(Ruvinsky et al. 2000)といった違いが見られる。
しかし、胸鰭、腹鰭、そして前後の四肢にかかわらず、その形成時にはHoxa9-13やHoxd9-13が前後軸や基部先端部軸(遠近軸)に沿って発現している。付属肢形成は3次元の発生であるからHox以外にもEgf8やWnt3aといった外胚葉頂堤シグナルによって制御される遠近軸、Shhといった極性化活性シグナルによって制御される前後軸、Wnt7aやEn1といった外胚葉からのシグナルによって制御される背腹軸といった3軸に関係する遺伝子コーディングタンパクを含め多種が関与している。そしてこれらをコードする遺伝子も鰭でも四肢でもその発現は保存されており、遺伝子ネットワークパターンも似ている。
例えば従来Shhは軟骨魚類の鰭形成には無関係とされたが(Tanaka et al. 2002)、鰭の前後を決めるShhは軟骨魚類でも条鰭類の鰭や四肢類の四肢と同様に機能していることが明らかにされた。Shh発現のタイミングと部位が違うことで、多様な鰭や鰭・四肢の形態変化が生じることが示された(Dahn et al. 2007)。他の軸性遺伝子においても同様の仕方で形態変化を決めていると考えられる。
付属肢の形成は魚類でも四肢類でもPhase1~3の3段階に分けられる。Phase1では柱脚部が、Phase2では軛脚部が、Phase3では自脚部が主に形成される。
Zebrafishとチキンの付属肢原基におけるHoxファミリー発現を比較した報告(Ahn & Ho 2008) (Davis et al. 2007)(Johanson et al. 2007)では、Zebrafishの胸鰭におけるHox遺伝子発現の様相と四肢類の前肢のそれとはよく似ていることが明らかにされた。

A:チキンの羽発生におけるHoxa遺伝子の発現 B:チキンの羽発生におけるHoxD遺伝子の発現 C:Zebrafishの胸鰭発生におけるHoxA遺伝子の発現 D:Zebrafishの胸鰭発生におけるHoxd遺伝子の発現 緑:Phase1における発現 青緑: Phase2初期におけるHoxD遺伝子の発現 青:Phase2後期におけるHoxD遺伝子の発現とPhase2におけるHoxA遺伝子の発現、HoxAのPhase2発現とHoxDのPhase2後期発現は似ている。 赤:Phase3における発現 ZebrafishのHoxa遺伝子発現は四肢類のPhase3におけるHoxd遺伝子発現に部分的に似ている From Ahn & Ho 2008
また、肉鰭類と分岐した後に条鰭類の系統では全遺伝子重複があったが、その前に条鰭類から分岐したヘラチョウザメの鰭形成も調べられている(Metscher et al. 2005)(Wagner & Chiu 2001) (Davis et al. 2007)。ヘラチョウザメの鰭も3段階の過程を経て形成されている。発生初期のphase1では付属肢原基の近位部でHoxa11とHoxd11-13が発現し、遠位部の外胚葉性頂堤:apical ectodermal ridge: AERでHoxa13が発現する。発生後期のphase3では、遠位部でHoxa11、Hoxa13とHoxd11-13が活性であれば鰭になる。従って、原初的な条鰭類とされるヘラチョーザメにおいても条鰭類と似たような遺伝子発現パターンとなっている。
さらにサメの発生段階における鰭形成過程を追った結果によると、軟骨魚類でも鰭は3段階を経て形成されている。AER:外胚葉性頂堤:apical ectodermal ridgeにおいてHoxd13の発現があればサメ型の鰭が、Hoxd13の発現が抑制されると条鰭が、Hoxd13の発現が強化されると肢になり指が形成される(Freitas et al. 2007)。そして肢の形成はAERからAEF:外胚葉性襞:apical ectodermal foldへの変換とも関係している。四肢類ではStage3でもAEFへの変遷が無く、Hoxd13の発現が強化されている。

サメ、ヘラチョーザメ、ゼブラフィシュ、マウスの鰭、及び肢形成と骨格形状の解釈
上段;外胚葉性頂堤:apical ectodermal ridge: AERから外胚葉性襞:apical ectodermal
fold: AEFへの変遷に対する仮想的なタイミング。マウスではAERは保持されAEF
転換は無い。緑は内骨格源細胞の増殖期を示す。
中段;鰭と肢原基の初期、及び後期におけるHoxd13発現域(青)。オレンジはAEF
下段;胸部付属肢の内骨格。緑:前柱脚、赤:中柱脚、黄:後柱脚。
鰭条皮は鰭内の無着色部。
共通祖先の対鰭内でPhase2の遠位Hoxd13が発現し(位置1)、真骨魚では消失する(位置2)。四肢類ではHoxd13発現の空間的分布が内骨格源細胞の増殖の時間的変調により変化(位置3)。早い段階でのAERのAEFへの転換はPhase2のHoxd13発現を中断、あるいは消失する。これによりゼブラフィシュに見るように鰭の内骨格が減少する。AERによるシグナルが伸びた場合、Phase2が長くなりHoxd13発現域が広がる。これにより四肢類に見られるような指が形成される。 From Freitas et al. 2007
最近Hoxd13ばかりでなくHoxAについても同様にAERからAEFへの変遷が早いと条鰭に、遅いと肉鰭になり、変遷が無いと四肢になるとの報告がされている(Yano & Tamura 2012)。付属肢原基におけるHoxAの発現時期と発現部位、及びAERからAEFへの転換時期との関係を図12にまとめて示す。
条鰭類の鰭ではAEFへの変遷時期が早い結果、Phase3における関連Hox遺伝子の発現様相が四肢類のそれよりも単純になっており、条鰭類の系統でHox遺伝子発現を制御する機能が失われたことを示している(Ahn & Ho 2008)。このことからも、先述した初期硬骨魚類の鰭は条鰭よりは軟骨魚類の鰭に近かったとする仮説が支持される。
鰭や四肢の発生の各段階で形成に関与するさまざまの遺伝子の発現状態はよく似ているが、比較的軽微な違いが見られる(Spitz et al. 2003)(Zakany et al. 2004)(Tarchini & Duboule 2006)。関与する多くの遺伝子発現のこういった軽微な違いの蓄積と軸性遺伝子の発現のタイミングと部位が違うことにより、鰭や四肢の多様な形態の違いが生み出されたと考えられる(Ahn & Ho 2008) (Dahn et al. 2007)。

形成されたAEFによって、四肢の内骨格形成が抑制されると考えられる。従ってAEFへの変遷時期が早いと条鰭になる。
自脚を含めた肢形成に関する新たなアプローチ
無顎類の時期に獲得した対胸鰭形成のメカニズムを顎口類は胸鰭と腹鰭の形成に引継ぎ、肉鰭を経て四肢へと進化させてきたことが、化石記録とエヴォ・デヴォの研究で明らかになった。四肢の基本構造に関して非常に古い時代からの鰭との相同性が確証され、Hox遺伝子の発現解析と自脚形成モデルにより発生段階における鰭と四肢の関係はかなり解明された。しかし、指の獲得が四肢類において新奇ではないにせよ、鰭から四肢への変換過程において最も遠位の指の獲得は従来考えられていた以上に複雑である。後放射骨:metapterygial radials の曲がりや指弓の起源とHox遺伝子発現との間に直接的な関係は見られず、遠位部における自脚の形成と進化の過程に関する理解は不十分である。
最近付属肢遠位部形成に対してcis-制御因子による遺伝子発現制御の機構に注目した報告が為されている(Abbasi 2011)(Sagai et al. 2004)(Schneider et al. 2011)。また、種々の遺伝子発現のパターンだけでは具体的な骨の形成過程を表しきれないとして、モルフォゲンの時空間における変化と遺伝子の機能を考慮した新たな四肢形成モデルも提案されている(Zhu et al. 2010)(Hentschel et al. 2004)(Benazet & Zeller 2009)。
形態的な違いは、形態を決める遺伝子にmutationが生じることによっても、cis-制御因子にmutationを生じることによっても起こりうる。Mutationが生じた場合、前者ではシノニム位置では形態に影響しないので、後者の方が形態変化をより容易に起こしうると考えられる(Carroll 2005)。
肢の骨は柱脚:proximal stylopod: humerus or femur, 軛脚:zeugopod: radius/ulna and tibia/fibula、及び自脚:autopod: wrist/ankle and digitsの3部分からなる。鰭と肢で柱脚と軛脚は相同性が明らかにされているが、自脚では鰭と肢を構成する各骨の相同性は必ずしも明らかではない。柱脚と軛脚ではHoxd1~13遺伝子が順次関与しており、発生後期の自脚ではHoxd13の発現が強く、Hoxd13~9遺伝子が関与している。発生後期のHoxD遺伝子発現は祖先の顎口類で既に起こっており、従って肢と鰭とで異なったHoxD遺伝子発現制御が行われていることを示唆している(Schneider et al. 2011)。
付属肢の発生を柱脚と軛脚が形成される初期段階と自脚が形成される後期段階に分けて見たとき、鰭の発生と肢の発生におけるHoxD遺伝子の発現に違いは、機能するcis制御因子が異なっていることに起因する。四肢類の肢形成におけるcis制御因子によるHoxD遺伝子の発現の様相を模式的に図13に示す。

A:肢におけるHoxD発現は初期(Phase1)と後期(Phase2)がある B:制御因子CsB(青)、CsA(赤)、CsC(黄)による制御領域 C:制御因子CsB(青)、CsA(赤)、CsC(黄)と遺伝子Lnp, Evx2, HoxD cluster(灰)の遺伝子座、及びヒト、マウス、チキン、カエル、ゼブラフィシュの制御因子CsB配列比較 From Schneider et al. 2011
発生の初期(Phase1)ではHoxD遺伝子の下流に位置するエンハンサーが発現を制御し、柱脚と軛脚の形成に関与する(Zakany et al. 2004)(Spits et al. 2005) (Deschamps 2007) (Tarchini et al. 2005)。発生の後期(Phase2)ではHoxD遺伝子の上流に位置する制御域GCR (Global Control Region) にある2つのエンハンサー域CsBとCsAの内、CsBが遠位部の形成に関与する(Spits et al. 2003)(Gonzalez et al. 2007)。CsBは四肢類と魚類の間でよく保存されている。一方、四肢類ではLnp遺伝子とEvx2遺伝子の間にある制御域CsCが遠位部の形成に関与している。CsC制御機構は四肢類に特有であり、付加的なCsC制御因子の獲得によりHoxD遺伝子の発現が拡大され、四肢類の自脚が形成されるようになったと考えられる。
新たなcis-制御因子が加わったことで指形成が起こったとする以外にも、cis-制御因子の作用位置が変化したことによって指が形成されるようになったとする報告もある(Abbasi 2011)。
この場合も柱脚と軛脚が形成されるPhase1と自脚が形成されるPhase2でcis-制御が異なっている。Phase1では3’側にある制御因子ELCR:Early limb control regulationがHoxd1, Hoxd2, Hoxd3, Hoxd4の順に作用すると共に、5’側にある制御因子POST:Posterior restrictionがHoxd13, Hoxd12, Hoxd11, Hoxd10の順に作用する。5’側で発現したHoxd11-13は、肢のShhの制御因子ZRSと作用してShhの発現を促す。Phase2では5’側のPOSTより外側にあるGCRがHoxd13, Hoxd12, Hoxd11, Hoxd10を活性化するとともに、Phase1で形成されたShh発現域もこれらHoxDの発現に関与する。

初期肢原基の発生におけるHoxdの発現は独立した二つのPhasesからなる。左;Phase1であり、Hoxd発現の最初は肢原基の出現とともに3’サイド(ELCR)と5’サイド(POST)の制御領域で始まる。ELCR要素(青矢印)はt1からt5へと、即ちd1-d4が先に時間軸に沿って作用していく。POST要素は逆にd10-d13に作用する。POST要素の作用強度は距離とともに弱くなる。このため初期にはHoxd13の発現は間充織細胞の後部分に限定され、一方Hoxd10の発現は広いが間充織細胞の前部分では見られない。後部に局所化した5’Hoxd遺伝子はZRS(Shhの肢特有の制御因子)と作用して肢の後縁部に沿って局所的なShh発現のトリガーとなる(明るい緑で表示)。その後Shhは肢原基の指形成部になる縁部(赤で表示)に沿ってPhase2の5’Hoxd遺伝子の発現に関与する。下;Phase2は5’側にある制御領域GCRの影響下にある。GCRは5’Hoxd遺伝子の発現を元に戻す。右;青で示す遠位のstylopodとzeugopodはphase1のHoxd発現で形成され、赤で示すautopodはphase2で形成される。肢原基中に点線は各Hoxdの発現境界を示す。 A:前方、P:後方
From Abbasi 2011
鰭芽や肢芽内において機能する種々の遺伝子の変遷とcis制御ネットを図15に示す。cis-制御因子の作用位置の変化が付属肢形成遺伝子ツールキット内の協調的相互作用のトリガーとなり、四肢類の指形成へと進化したと考えられる。

関連する遺伝子ツールキット協調の基礎がcis制御ネットである。四肢類の自脚パターニングの間5’Hoxdの上流と下流で遺伝子が機能するが、これらは硬骨魚と軟骨魚の共通祖先の付属肢形成ですでに使われていたであろう。黒で表示した遺伝子は発現が確認されている。赤で表示した遺伝子は主に鰭において発現すると考えられるが、まだ確認されていない。鰭におけるこれらの遺伝子間の相互作用はほとんど不明である。四肢類の肢原基では赤と緑で示される制御の機能も明らかにされている。黒で表示した相互作用はcis制御を通じた仮定的な制御線である。点線は、転写因子:Shh, Gre, Bmp, Fgf, Wnt7aばかりでなく、下流のエフェクターを通じた遺伝子のcis作用位置との相互作用を示す。自脚パターニングの遺伝子は保存されており、肉鰭類における自脚の形成はcis作用位置の変化を通じた相互作用のシフトを伴ったに違いない。cis作用位置の変化が付属肢形成遺伝子ツールキット内の協調的相互作用が変化するトリガーとなり、これが四肢類の自脚形成の促した。
*:cis制御因子、AER:外胚葉性頂堤、zpa:極性化活性領域、pr:近位、dist:遠位、ant:前方、post:後方
鰭や四肢形成にかかわる遺伝子の種類は多いが、これには顎口類の出現の頃に起こったとされる全遺伝子重複、所謂2Rが関与していると考えられる。全遺伝子重複により機能する遺伝子や遺伝子間の相互作用が拡大し、これにより鰭や四肢が多様な形態をとることが可能になったと考えられる。また、発生研究から、対鰭形成の発現パターンは軟骨魚類が出現したときには既に獲得されていたと考えられる(Ahn & Ho 2008)。恐らく現生種の鰭や四肢につながる対鰭を持った無顎類の系統である骨甲類:Osteostraciの時代に、対鰭形成遺伝子の発現パターンの原型が出来上がったと思われる。そして軟骨魚類や棘魚類はこの対鰭形成遺伝子の発現パターンを腹鰭形成にリクルートしたとされる。
cis制御因子が加わることで指形成の詳細が明らかになったが、依然として主軸である後放射骨の曲がりをHox遺伝子等だけで説明するのは困難である。種々の遺伝子発現のパターンだけでは具体的な骨の形成過程を表しきれないとして、モルフォゲンの時空間における変化を組み込んで四肢形成を解明する手法も提案されている(Zhu et al. 2010)(Hentschel et al. 2004)(Benazet & Zeller 2009)。
骨形成に関与する遺伝子の各々に対して、骨形成を加速するモルフォゲンと抑制するモルフォゲンの濃度変化を拡散方程式で求めて、骨形状を決めるるもので、正負制御フィードバックが入った総合的な時空間パターンによる骨の形成制御を扱っている。生物の体表模様を説明したチューリングのモデルに遺伝子の機能を入れ込んだモデルとみなせ、器官形成過程を可視化できる新しい試みのように思える。このモデルでは主軸の曲がりという遺伝子だけでは説明しがたい難点を避けられる。また、拡散や遺伝子の発現を3次元的に扱えば、形成される器官の形状を具体的に表現できる可能性があると思われる。
モルフォゲンの拡散と遺伝子発現を組み合わせたモデルに基づいたシミュレーションは鰭・肢化石の結果をよく説明している。
鰭筋肉の進化
以上述べてきたように、鰭および四肢の形状や骨に関する進化の過程は、化石記録と分子生物学的解析から明らかにされてきた。一方、脊椎動物の陸生化に際しては、重力に抗して体重を支え移動するために、骨の強化とともに筋肉の強化も必要である。しかし、鰭や四肢を構成する筋肉は化石記録がほとんど無いため、付属肢の筋肉の進化に関する研究は困難であり報告も少なく、主に現生動物の筋形成から類推されている(Cole & Currie 2007)(Haines & Currie 2001)(Neyt et al. 2000) (Gross et al. 2000)(Cole et al. 2011)。
従来、魚類では筋上皮体節が直接鰭内に伸びて(epithelial somatic extension)鰭筋肉を形成するが(Kardong 1995)、羊膜類では先駆筋芽細胞が肢芽位置に移動し増殖することによって肢筋肉を形成する(Gross et al. 2000)、とされてきた。
羊膜類の先駆筋芽細胞で発現するlbx1とmox2を使ってゼブラフィシュとサメ:dogfishの胸鰭芽形成を調べられた(Neyt et al. 2000)。その結果サメでは筋節から筋上皮が直接胸鰭内に伸びて胸鰭筋肉を形成するが(以降伸張方式と呼ぶ)、ゼブラフィシュでは側板中胚葉に由来する体節でlbx1の発現が見られ、ここから間充織前駆細胞:mesenchymal precursor cellsの移動で誘導された肢筋芽細胞から胸肢筋肉が形成される(以降拡散方式と呼ぶ)ことが明らかになった。なお、サメでもLBX蛋白質は形成されるが、鰭の筋肉には使われていない。一方、mox2はゼブラフィシュでもサメでも発現している(Gillis & Shubin 2009)。即ち、従来説とは異なり先駆筋芽細胞が移動し胸鰭筋肉を形成するメカニズムは、軟骨魚類と分岐した後に硬骨魚類の系統で獲得されたことになる。
棘魚類の胸鰭は棘で固定されており、あまり可動性は無かったと考えられる。従って、棘魚類の胸鰭筋は、軟骨魚類と同様の機構によって形成されていたであろう。

a. 軟骨魚類の鰭筋形成過程(伸張方式) b. 硬骨魚類の胸鰭筋と四肢類の四肢筋形成過程(拡散方式) From Cole 2007
魚類では体軸筋肉の収縮を使って体を左右にくねらせる移動方式であるが、四肢類では付属肢の筋肉を使った移動方式になっている。陸上における四肢による移動方式では特に後肢が主要な推進力を生み出しており、化石記録では腹側の骨や鰭骨が次第に強化され、背側の頑丈な腰帯と後肢へと変化していく過程が追える(Ahlberg et al. 2005)(Ahlberg et al. 2008)(Clement et al. 2004)(Ahlberg & Johanson 1998)(Daeshler et al. 2006)。しかし、後肢の筋肉系の進化過程に関する報告はほとんど無い。
腹鰭の筋肉形成は軟骨魚類、条鰭類、肉鰭類で異なっていることが、最近明らかにされた(Cole et al. 2011)。条鰭類の胸鰭の筋肉は肉鰭類や四肢類と同様間充織前駆細胞の移動により形成されるが(拡散方式)、腹鰭の筋肉形成は軟骨魚類と肉鰭類の中間の過程を示すことが明らかにされた。即ち、図18に示したように、条鰭類やハイギョの腹鰭形成の最初の段階ではサメと同様上皮体節から筋細胞に分化した部分が伸びてくるが、発生の後半になると胸鰭や四肢と同様に間充織前駆細胞の移動方式になる(以降中間方式と呼ぶ)。

条鰭類の腹鰭筋は軟骨魚類の鰭筋と羊膜類の四肢筋の中間の過程によって形成される。 From Cole et al. 2011
古生代の軟骨魚類の胸鰭は根元が広く、可動性があまりなくてほぼ固定翼としての機能しか持っていなかったと考えられる。また、棘魚類の胸鰭も固定されており、可動性はあまり無かったと考えられる。従って、鰭の筋肉も微妙な動きを要求されなかったため、鰭筋が体節と結合していても機能的には充分であったと思われる。初期硬骨魚類において筋芽前駆細胞の拡散方式により胸鰭筋肉を、中間方式で腹鰭筋を形成できるようになり、対鰭筋が体節から独立して形成されるようになった。このため胸鰭と腹鰭の運動機能が向上し、これら対鰭を微妙に動かすことが可能になった。遊泳性の初期硬骨魚類と条鰭類、それに初期肉鰭類は、機能的な対鰭を獲得したことにより、先行する遊泳型の軟骨魚類や棘魚類と競合できたと考えられる。
さらに肉鰭類が四肢類へと進化したとき、後肢の筋肉形成も拡散方式に進化したと思われる。条鰭類と肉鰭類で腹鰭の筋肉形成過程に違いが生じたのは、肉鰭類では浅瀬や潟を這い回るために後肢による推進力が必要とされたためと考えられる。腹鰭筋も胸鰭筋と同様に拡散方式により体節から独立して形成されるようになり、さらに柱脚骨が一本になって腰帯に関節することにより、対鰭の運動の自由度が増し、潮汐域や草木の茂る三角州、泥濘地を移動できるようになったと思われる。前肢、後肢の筋肉がともに拡散方式で形成されるようになったことで、四肢類は枝分かれ的に骨が伸張し指の形成までたどり着いたのだが、その各々の骨に必要な筋肉を付けることを可能にしたと考えられる。
対鰭筋肉の形成方式を表にまとめる。
|
|
軟骨魚類 |
初期硬骨魚類 |
条鰭/肉鰭類 |
四肢様/四肢類 |
|
胸鰭 |
伸張方式 |
拡散方式 |
拡散方式 |
拡散方式 |
|
腹鰭 |
伸張方式 |
中間方式 |
中間方式 |
拡散方式 |
シーラカンスに関する対鰭筋形成に関する知見はないが、分岐時期はハイギョより早いとされており、従って条鰭類やハイギョと同様の方式で胸鰭筋や腹鰭筋が形成されていると予想される。現生シーラカンスの胸鰭と腹鰭は微妙な動きが可能であることが確認されており、これはシーラカンスの胸鰭筋は拡散方式で、腹鰭筋も伸張方式ではなく少なくとも中間方式で形成されている可能性を示唆している。
胸鰭と脊髄神経の進化
胸鰭筋は鰭の運動機能を向上させる方向に進化して、これがさらに上陸イヴェントでは重力に抗する筋肉の発達へとつながった。こういった鰭から四肢への機能変化は運動神経系の変化と連動していたと考えられるが、神経系に関連した研究は鰭筋の進化に関する研究以上に少ない。もちろん神経系の化石記録もほとんど無いので現生動物の鰭・前肢神経形成から類推せざるを得ない(Ma et al. 2010)。
軟骨魚類、条鰭類、ハイギョ等各種の魚類の胸鰭神経形成過程と哺乳類や鳥類の前肢神経形成過程を比較した結果、運動神経形成に関与するHox遺伝子は同じであるが、発現の位置が進化に伴って後脳・脊椎部から脊椎部へとシフトしていることが明らかになった。このようなシフトが起こった原因は、初期魚類では頭蓋と胸帯が一体化していたのが、四肢類への移行に伴って分離し頚骨が形成されたことによるとされる。

a. 現生顎口類の分岐図;後頭部神経(赤:胸筋、灰色:下鰓節)と脊髄神経(青)b. 魚類と四肢類の前後軸に沿った神経(上)と中胚葉(下)における主要Hox遺伝子の発現状態
Oc1―4;occipital nerve code Sp1―11;spinal nerve code From Ma et al. 2010
魚類の胸鰭筋の運動神経は後脳と脊髄によって制御されている。体軸に沿ってHox遺伝子発現の位置がシフトしたことにより、胸鰭筋を制御している運動神経と後脳のつながりが弱まり、四肢類のように脊髄神経が制御するようになったと考えられる。
遊泳型の肉鰭類がいつ底生型の肉鰭類に変ったのか?
初期硬骨魚は遊泳性であり、初期硬骨魚類から分岐した肉鰭類も多くは最初遊泳性であったと考えられる。肉鰭類が出現した頃は既に遊泳性の軟骨魚類や棘魚類が棲息しており、遊泳性を引き継いだ初期肉鰭類はこれらと競合したことになる。軟骨魚類や棘魚類の鰭はほとんど可動性が無かったが、初期肉鰭類は尾鰭による推進力に加えて、拡散方式と中間方式で形成した鰭筋肉によってかなり対鰭を動かすことが出来たと思われる。初期肉鰭類は軟骨魚類や棘魚類より遅れて出現したが、機敏な遊泳力により、棲息域を拡大できたのであろう。
しかし、浅瀬で肉鰭類から四肢類へと進化したのであるから、遊泳型の肉鰭類はどこかの時点で底生型へと変ったと予想される。
395Mya頃に棲息していたKenichthysは陸棲脊椎動物の特徴とされる内鼻孔を持っており、底生型への移行はKenichthysの頃に始まったと見られる。遊泳性であれば外鼻孔内の水流は自動的に起こるが、底性化すると鼻孔内水流を自発的に起こす必要が生じる。そのため後外鼻孔を口腔内に移し、鰓を機能させて鼻孔内水流を確保したと思われる。
また385Mya頃に出現したEusthenopteronの対鰭には四肢の原型が見られる。底生からさらに潮汐域や三角州などの浅い水域に進出したときに、泥濘の水域や草木の茂る水域を移動するために、鰭の四肢化が起こったと思われる。柱脚骨が3本から1本になり、対鰭から四肢様鰭へと進化し、四肢様鰭を使った移動運動が可能になったと考えられる。
初期肉鰭類が遊泳型から底生型へと移行したのは、より遊泳能力に優れた条鰭類が390Mya頃から放散を始めたことも一因と思われる。420Myaには肉鰭類と分岐していた条鰭類が肉鰭類より遅れて放散を開始した理由は、明らかではない。初期硬骨魚類の鰭形状は軟骨魚類の鰭形状に近かったが、その鰭形状が条鰭よりは肉鰭に近かったため肉鰭の方が容易に形成されたのかもしれない。
デボン紀中期、Eifelian期397Myaの足跡化石について
従来はデボン紀後期365Mya頃とされていた指の獲得時期は、397Myaとされる指を持った足跡化石の新たな発見により見直しが必要とされている(Niedzwiedzki et al. 2010)。
指を持った足跡化石の新たな報告以降、四肢と指の形成時期に関して幾つかの仮説が提案されている。いずれの論文も397Myaに既に指を持った四肢様魚類が棲息していた可能性を支持しており、それを如何に説明するかを考察している。
化石の統計的処理の結果、指の獲得時期はmid Ludlow(421Mya) ~late Emsian (390Mya)と考えられるとする解釈が出されている(Friedman & Brazeau 2010)。あるいは、鰭から四肢への変換初期には多様な形態があり、その中に指が先行して獲得された可能性がある(Geroge & Blieck 2011)。また、遺伝子のわずかの変化で肢芽が影響を受ける可能性があり、かなり早い時期に四肢様付属肢を創り出した種がいた可能性がある(Zhu et al. 2010)。さらには、鰭から四肢への変換が従来説とは異なり早期に急激に起こった可能性がある(Janvier & Clement 2010)(Coates et al, 2002)(Shubin et al. 2004)。実際、最近鰭の繊維状コラーゲンの主要成分蛋白質And1 (actinodin1)とAnd2 (actinodin2)を産生する遺伝子and1とand2の発現を抑制することにより肢原基が容易に形成されることが明らかにされた(Zhang et al. 2010)。これはand1とand2遺伝子の発現制御により、かなり急激な鰭・肢変換が可能であることを示唆している。
ところで指を持ったこの足跡化石のサイズをイクチオステガやアカントステガのそれと比較すると、サイズはイクチオステガの2~3倍、アカントステガの5~6倍はある。従って、デボン紀中期の初め397Myaには2.5~5メートルにもなる大型の幹四肢類がローレンシアの南海岸潮汐域に棲息していたことになる。395Myaの時点でこれほど大型の魚類が潟や潮汐域で移動可能であったのか疑問が持たれる。
こういった大型の肉鰭類はとしては、デボン紀後期のMandageria やEusthenodonが知られている。前者は2メートル強の体長で、待伏せ方式の摂食行動を採っていたとされる。後者は2.5メートルを越す体長で、陸上を這うことも可能だったとされる。しかし、デボン紀中期の初め頃の大型の肉鰭類化石の報告は無いようである。
最も遠位の指の獲得機構は従来考えられていた以上に複雑であることが最近明らかにされた(Abbasi 2011)(Sagai et al. 2004)(Schneider et al. 2011)。即ち、指の形成は容易なことではなく、進化の観点で時間を要すると考えられる。デボン紀末には多くの肉鰭類が潮汐域、潟、草木の茂る三角州に棲息しており、潮汐域や泥濘地を四肢を使って移動するために、その支点としての指の必要性は高かったと考えられる。しかし、発見されている50種ほどの四肢様魚類や四肢類のなかで指を持っていたのはアカントステガ、イクチオステガ、チューレルペトンの3種だけである。これは指を持つことが容易でないことを反映していると考えられる。
395Myaに棲息していたKenichthysの内鼻孔は口中を咽頭部に向かって移動を始めた初期の段階であり、内鼻孔の形成は底生化への適応と考えられるので、肉鰭類の底生化はこの頃から始まったと思われる。また、385Myaに棲息していたEusthenopteronは肩帯や腰帯を含め四肢の基本骨格を持っており、さらに顎の構造や牙の保持、頭頂骨の結合状態などから待伏せ型の吸引方式で餌の捕獲を行っていたとされる(Markey & Marchall 2007)。噛付き方式になるのはAchnthostegaの段階以降になってからであり、底生化した肉鰭類の捕獲行動は400~365Myaの間は待ち伏せ型であったと考えられる。従って397Myaに足跡化石を残した魚類が肉鰭類であれば待ち伏せ型であったと考えられる。待伏せ型であれば、急激な捕食行動のためには鰭の先に突部があったほうが海底面を蹴るのに有利である。従って、所謂指ではなくて、柱脚骨に続く放射骨:radialsが突起として機能した可能性があると思われる。突起を持った鰭が着けた跡であれば、大きな足跡のように見えることも有り得る。さらには浅瀬に棲息する鰭を持つ魚類であれば、肉鰭類に限定されないであろうが、条鰭類は397Myaの時点ではまだ本格的な放散を開始してはいない。
まとめ
脊椎動物は無顎類の時期に獲得した対胸鰭を顎口類でも引継ぎ、さらに顎口類の出現時に対腹鰭を獲得した。軟骨魚類より遅れて出現した初期硬骨魚類は鰭筋形成機構を変えて鰭の動的機能の向上を図り、軟骨魚類や棘魚類に伍して遊泳魚類としての地位を築いた。初期硬骨魚類から分岐した肉鰭類も最初は初期硬骨魚類の遊泳性を引き継いだが、395Mya頃には底生へと棲息域を変えた肉鰭類も多かった。底生の肉鰭類の一部はさらに385Mya頃には潟や三角州などの潮汐域や浅い水域に進出した。潮汐域や浅い水域での移動や捕食活動のために肩帯、腰帯の強化と対鰭から四肢への進化が進み、365Mya頃には移動に際して支点となる指を獲得した。しかし、陸上歩行が可能な四肢を得たのは、石炭紀に入ってからの350~346Mya頃である。
化石報告に加え、遺伝子解析による鰭や四肢形成に関する報告数は膨大であり、この分野の進化を含めた問題はかなり解明されてきた。しかし、鰭と肢の遠位部の大きな違いの解明はまだ充分ではない。従って、鰭から四肢への変遷過程は依然として進化の中心テーマになっている。また、397Myaに既に指を持っていた四肢様魚類の存在を確認するには、当時の潮汐域や潟、三角州における新たな化石の発見を待つ必要がある。
図20に初期の胸鰭獲得から5指獲得までの経緯をまとめて示す。

1:胸鰭の獲得 2:腹鰭の獲得 3:伸張方式胸鰭筋形成 4:拡散方式胸鰭筋形成
5:中間方式腹鰭筋形成 6:肉鰭類・条鰭類分岐 7:肉鰭類底生化 8:肉鰭類潮汐域進出 9:拡散方式腹鰭筋形成 10:柱脚骨1本化 11:四肢骨系原型形成 12:四肢化
13:多指形成 14:5指固定 15:陸上歩行可能四肢形成 赤数字は仮説である
 魚が陸上を歩くまで
魚が陸上を歩くまで